IT之家 10 月 28 日消息,美国食品药品监督管理局(FDA)今日公布警告信:检查发现,皇家飞利浦(Royal Philips)公司在美国 Bothell、Reedsville 和荷兰工厂生产的设备存在掺假问题。
飞利浦方面回应表示:对此高度重视,并已按照监管要求提交了相关材料。受此消息影响,飞利浦股价下跌 5.63%,目前市值约 221 亿欧元(IT之家注:现汇率约合 1830.08 亿元人民币)。
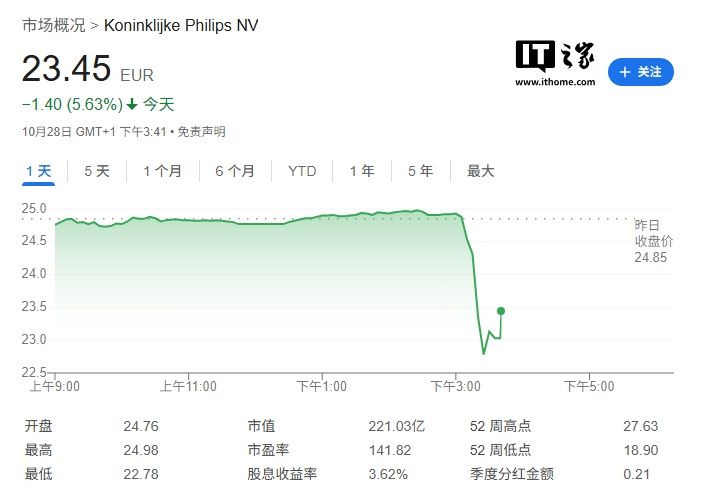
FDA 信中指出,FDA 在对飞利浦位于美国华盛顿 Bothell、宾夕法尼亚 Reedsville 以及荷兰 Eindhoven(Nederland)三处医疗器械生产 / 开发设施的检验过程中,发现多项不符合《联邦食品、药品与化妆品法案》及其实施细则《质量体系条例》和其他相关法规的情形,要求公司在收到信件后 15 个工作日内书面回复未充分解决事项并提交纠正措施与时间表。
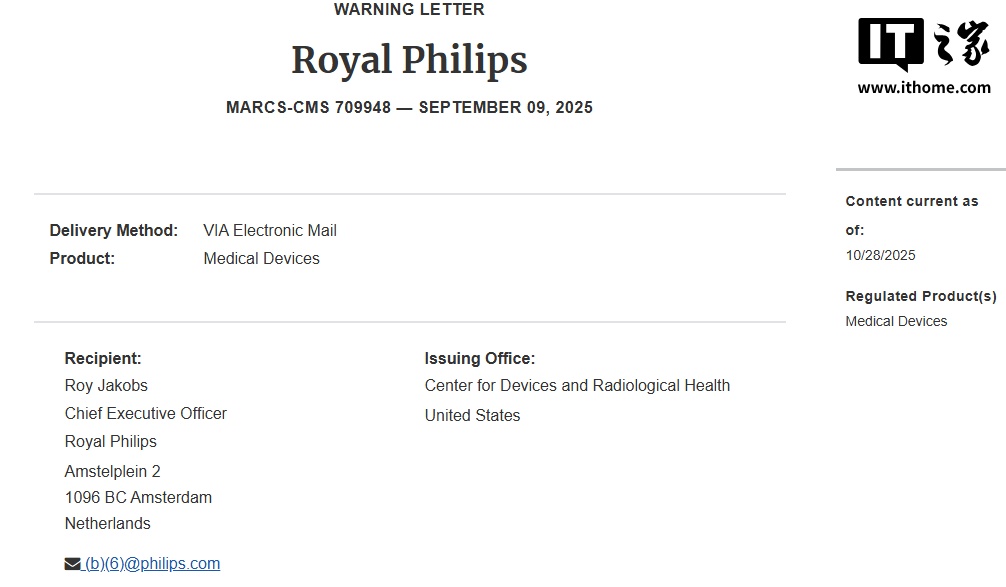
检查时间与地点:
Philips Ultrasound, LLC(Bothell,地址:22100 Bothell Everett Highway, Bothell, WA;FEI No. 3019216),检查时间:2025 年 1 月 13 日 —2025 年 1 月 31 日。
Philips Ultrasound, LLC(Reedsville,地址:1 Echo Drive, Reedsville, PA;FEI No. 2518586),检查时间:2025 年 1 月 23 日 —2025 年 3 月 13 日。
Philips Medical Systems Nederland B.V.(Nederland,Eindhoven, the Netherlands;FEI No. 3000976525),检查时间:2025 年 1 月 13 日 —2025 年 1 月 17 日。
FDA 在检查中认定,上述工厂制造的产品均属医疗器械,包括在 Bothell 制造的 EPIQ Elite 超声系统、在 Reedsville 制造的超声探头、以及在 Nederland 制造的 IntelliSpace Cardiovascular 和 eCareManager。
FDA 认为,上述设施在制造、包装、储存或安装器械所采用的方法、设施或控制不符合《质量体系条例》中的现行良好生产规范,因此这些器械被视为“掺假”(adulterated),违反了《法案》第 501 (h) 条(21 U.S.C. § 351 (h))。
]article_adlist–>
<!-- 非定向300*250按钮 17/09 wenjing begin --> <!-- 非定向300*250按钮 end -->
</div>

